https://www.youtube.com/watch?v=SuAxDVBt7kQ
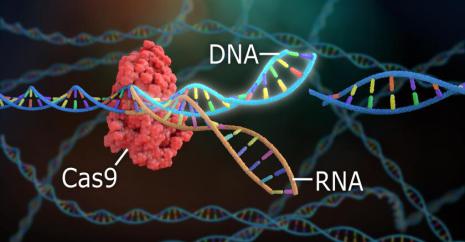
Nobel Prize in Chemistry 2020: the Crispr-Cas9 molecular scissors.
The two geneticists, Jennifer Doudna (UC Berkeley) and Emmanuelle Charpentier (Max Planck Unit) published their discovery in the journal Science, in 2012. Since then, this technique has completely
revolutionized research: cancer, genetic diseases, HIV, cellular aging, resurrecting the mammoth, the dodo...
This system was discovered in bacteria that could store viral DNA in their own DNA in order to use it later against future attacks! It targets and cuts off viral material. Since then, this
molecular scissor has been used to modify the DNA of animals, plants and microorganisms with a high degree of precision.
Prix Nobel de Chimie 2020 : le ciseau moléculaire, système Crispr- Cas9.
Les deux généticiennes, Jennifer Doudna (UC Berkeley) et Emmanuelle Charpentier (Max Planck Unit) ont publié leur découverte dans la revue Science, en 2012. Depuis, cette technique a complètement bouleversé la recherche: cancer, maladies génétiques, VIH, vieillissement cellulaire, ressusciter le mammouth, le dodo...
Ce système a été découvert chez des bactéries qui pouvaient conserver de l'ADN de virus dans leur propre ADN pour l'utiliser contre de futures attaques! Il cible et tranche le matériel viral. Depuis, ce vrai ciseau moléculaire est utilisé pour modifier l'ADN d'animaux, plantes et microorganismes avec une très haute précision.
https://www.nature.com/articles/d41586-025-02800-7
First CRISPR horses. These horses might look like ordinary horses, but there is something highly unusual about their genomes. They are the first of their species to have their DNA edited using CRISPR–Cas9. The horses are clones of the prize-winning steed Polo Pureza, but they have a tweak to myostatin — a gene involved in regulating muscle development — that is designed to quicken their pace. CRISPR was used in fetal fibroblasts (connective tissue cells) to generate embryos through cloning, and then the embryos were implanted into mares. 09/25
The CRISPR horses join a menagerie of gene-edited animals that have wide- ranging — mostly with the goal of improving agriculture. With a similar goal, researchers in India announced the first CRISPR-edited sheep earlier this year. As with the Argentine horses, the scientists edited the myostatin gene of the sheep to increase muscle mass. Disease resistance is another reason that scientists are producing CRISPR animals. Genus, a company based in Basingstoke, UK, has used CRISPR to generate pigs that contain a mutation in the CD163 gene. This makes them resistant to a virus that causes porcine reproductive and respiratory syndrome (PRRS), which can be deadly for suckling pigs. In 2020, the FDA approved the gene-edited pigs for sale in the United States, and they are expected to go on the market there in 2026 Researchers are also using CRISPR to make animal products that are safer for human consumption. GalSafe pigs, made by Revivicor in Blacksburg, Virginia, are designed to be a source of hypoallergenic meat. Researchers use CRISPR to inactivate the GGTA1 gene, which produces alpha-gal, a sugar molecule found in most mammals that can cause allergic reactions in humans who eat red meat.
https://www.youtube.com/watch?v=TyLoaVTqhqU
Colossal Biosciences has edited 20 genes from a gray wolf to get a canine similar to a species extinct 13 000 years ago. A controversial "de-extinction" project to create the wolf of the series "Game of Thrones". The American start-up showcased mice with abundant fur regarded as a step toward the ressurection of the woolly mammoth.
Ancient DNA was extracted from fossils: a 13 000 year old tooth and a 72 000 year old skull. The genome sequence of these genitically modified wolves is 99.5% identical to the one of the gray wolf, meaning that only 12 million base pairs of the DNA sequence are different. An edifying DNA system was used on gray wolf blood cells. The genetically modified nuclei were injected into dogs eggs whose nuclei had been removed. The surrogate dogs are big in order to be able to give birth to the GMOs. These wolves are expected to be 25% larger than the current species and have a lighter coat. The start up goes on working on the ressurection of the woolly mammoth, the dodo and the Tasmanian tiger... 04/25
https://hms.harvard.edu/news/first-genetically-edited-pig-kidney-transplanted-human
Genetically Edited Pig Kidney transplanted into Human. American surgeons transplant a genetically modified pig kidney into a 62-year-old living
patient. The patient had previously received a human kidney transplant, but that kidney showed signs of failure after five years, sendig him back to dialysis with end-stage kidney failure and
requiring regular hospital visits for management of dialysis complications. 03/24
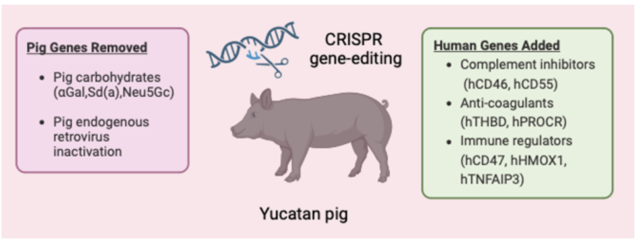
Genetically Edited Pig Heart transplanted into Human. Surgeons in Baltimore successfully performed a unique xenograft of a genetically
modified pig heart on a 57-year-old man: 3 genes were removed to limit rejection of the heart by the transplanted human, 6 human genes were added to the pig heart and 1 gene was added
to block heart growth. The man did not survive for a long time only 3 weeks (but he was about to die). Because of organs shortages, xenotransplantations seem to be a solution. However, an ethical problem is also being raised...01/22
Des chirurgiens américains ont transplanté un rein de porc génétiquement modifié sur un patient vivant de 62 ans. 03/24
Transplantation d'un coeur de cochon humanisé. Des médecins de Baltimore ont réalisé avec succès, une xénogreffe unique d'un coeur de cochon génétiquement modifié sur un homme de 57 ans: 3 gènes ont été enlevés pour limiter le rejet du coeur par l'homme greffé, 6 gènes humains ont été ajoutés au coeur de cochon et 1 autre gène ajouté pour bloquer la croissance du coeur. (grâce à la technique CRISPR-Cas-9). L'homme n'a pas survécu. Face à la pénurie d'organes, la xénotransplantation semble être une solution. Cependant, un problème éthique est également soulevé...01/22
https://www.youtube.com/watch?v=McgnzjxybTs
https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(23)00313-7/fulltext
Tubular myopathy: like others myopathies, this is a disease affecting muscle function, particularly the striated skeletal muscles involved in walking or breathing. As a result, children affected by this disease can't hold their head up, sit up or breathe on their own. For half of them, life expanctancy is less than 2 years. This disease is due to several mutations in the MTM1 gene, located on the X chromosome. This gene codes for a protein called myotubularin involved in muscle excitation- contraction (making the muscles contract). By using CRISPR-Cas9, the researchers inserted the gene into a virus that had been stripped of all its genes except those making the viral envelop and those enabling it to go into host cells. The genetic therapy has been directly injected into the patients. The results got on 24 patients are impressive: increased muscle strength and improvement of breathing and motor functions. 16 children can breathe on their own, 12 can stand up and 8 can walk by themselves. Unfortunately, lethal side effects were noticed for 4 patients who died of liver disease. To be continued...12/23
The world's first CRISPR therapy approved. Sickle cell anemia, the most widespread monogenic disease in the world (300,000 births worldwide) treated by gene therapy using CRISPR-Cas9. Patient cells are harvested and CRISPR-Cas9 modifies the genome, thus correcting it. The cells are then reinjected into the patient. The clinical results got on 70 people are impressive: sickle cell patients no longer need transfusions, and their pain attacks are reduced. Some of them, who were on the verge of death, feel completely better! 11/23
Myopathie tubulaire: comme toutes les myopathies, c'est une maladie qui atteint les muscles, en particulier les muscles striés squelettiques soit ceux qui servent à la marche et aussi à la respiration. Ainsi, les enfants ne peuvent pas tenir leur tête, ils ne peuvent pas tenir assis, manger ou respirer sans assistance. Le pronostic est donc sévère et l'espérance de vie de la moitié d'entre eux ne dépasse pas deux ans. La maladie est due à des mutations dans le gène MTM1, gène qui est localisé sur le chromosome X. Ce gène code pour une protéine qui s'appelle myotubularine, et qui favorise le mécanisme d'excitation-contraction soit le couplage avec le message nerveux pour pouvoir faire la contraction du muscle. Les muscles soit les fibres musculaires sont de plus petite taille avec une structure anormale. Grâce à CrisprCas9, les scientifiques ont inséré le gène sain à un virus qu'ils ont préalablement dépouillé pour ne conserver que son enveloppe et sa capacité à pénétrer dans les cellules humaines. La thérapie génique est directement injectée au malade. Les résultats sur 24 patients sont impressionnants: augmentation de la force musculaire et une amélioration de la fonction respiratoire et de motricité. 16 enfants capables de respirer par eux-mêmes, 12 peuvent se tenir debout et même 8 peuvent marcher seuls. Malheureusement, des effets secondaires graves ont été constatés chez 4 patients décédés d'une atteinte du foie. Affaire à suivre...12/23
La drépanocytose maladie monogénique la plus répandue dans le monde (300 000 naissances dans le monde) traitée par thérapie génique utilisant CRISPR-Cas9. Les cellules des patients sont prélevées et CRISPR-Cas9 modifie le génome et donc corrige ces cellules. Les cellules sont ensuite réinjectées dans le patient. Les résultats cliniques sur 70 personnes sont spectaculaires, les patients drépanocytaires n'ont plus besoin de transfusion et voient leurs crises de douleur diminuer. 11/23
https://www.youtube.com/watch?v=jQ28IOhU_Bk
https://www.nature.com/articles/d41586-023-01630-9
90% of deaths due to mushroom ingestion are caused by death caps. Drug developers discovered a potential antidote for death cap's toxin using CRISPR technology. This chinese team used CRISPR-Cas9 to develop a pool of human cells, each with a mutation in a different gene. Then they looked for the mutations that made the cells endure exposure to alpha amanitin, one of the most dangerous compounds in nature which is present in both deadly jellyfish and death caps. The CRISPR screening led them to cells lacking functional STT3B enzyme, which can survive alpha amanitin. STT3B enzyme is ivolved in a biochemical pathway that adds sugar molecules to proteins. When this pathway is impeded, amanitin is also blocked from entering cells and prevented from causing destruction. Then they sifted through 3200 chemical compounds that could block STT3B action. They found indocyanine green, a dye developed for photography and used for medical imaging. Tests showed that only half of the mice treated with indocyanine green died due to alpha- amanitin poisoning, comapred to 90% of those that were not treated. 05/23
https://www.youtube.com/watch?v=ADNDIixeXG0 (be careful, it's not objective at all, critical thinking!)
The wooly mammoth is back...in the form of a meatball! 03/23
Woolly mammoth meat created in vitro by Australian cultured meat company. They used the sequence of a mammoth protein, myoglobin, a protein close to hemoglobin, which is capable of carrying oxygen into the muscle. But as pieces of this protein's sequence were missing, and the sequencing of this ancient DNA wasn't perfect, they filled in the gaps with elephant DNA. Then, they transferred it to sheep cells to make these muscles grow in the laboratory.
It looks more like a three-meat kebab than a real mammoth meatball, but it is above all a symbol of the mammoth's disappearance because of previous climate changes. The operation also aims to raise awareness of how it could be the perfect alternative to eat meat made in vitro (less polluting, more respectful with animals...). The mammoth meatball is not yet edible. Many tests still need to be carried out before a human can taste it.
De la viande de mammouth laineux créée in vitro par la société australienne de viande cultivée Vow. Pour cela, ils se sont servis de la séquence d’une protéine de mammouth, la myoglobine, une protéine proche de l’hémoglobine, qui est capable de transporter l’oxygène dans le muscle. Mais puisqu’il en manque de bouts de cette protéine, le séquençage de ces ADN anciens n’étant pas parfait, ils ont comblé les lacunes avec de l’ADN d’éléphant puis transféré dans des cellules de mouton pour petit faire pousser ces muscles en laboratoire.
Cela ressemble donc plus à un kebab trois viandes qu’à une véritable boulette pur mammouth mais c’est surtout un symbole de la disparition du mammouth face aux précédents changements climatiques. L’opération vise aussi à faire parler de ces alternatives à la viande que représente la viande in vitro. Et la boulette n'est pas encore comestible. De nombreux tests doivent encore être réalisés avant qu’un humain puisse la goûter.
https://www.youtube.com/watch?v=IPe4IdgKGdQ
The mammoth soon?
A Japanese team has been working on the mammoth cloning project since the early 2000s. These researchers
removed cells from Yuka, a baby mammoth discovered in the frozen ground of Siberia in 2013. From these cells, the researchers took off the nuclei and injected them into mouse sex cells.
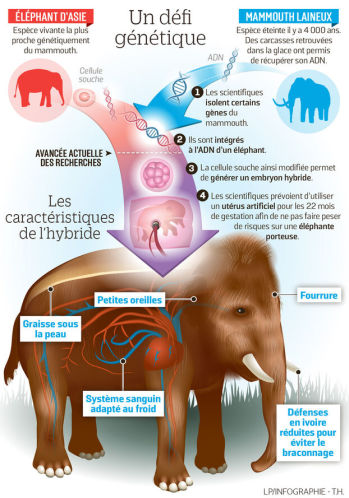
Since 2015, geneticist George Church's teams from Harvard University have been aiming to produce a hybrid embryo between an elephant and a
mammoth, using the Crispr Cas9 molecular scissors (Nobel Prize in Chemistry 2020) that can allow the scientists to cut DNA at the chosen location. They
could also extract and replace parts of the Asian elephant genome with DNA fragments from mammoths preserved in Siberian ice.
En route pour le mammouth?
Une équipe japonaise se consacre à ce projet de clonage du mammouth depuis le début des années 2000. Ces chercheurs ont extrait des cellules de Yuka, un bébé mammouth découvert en 2013 dans le sol gelé de Sibérie. De ses cellules, les chercheurs ont extrait les noyaux pour les injecter dans des cellules sexuelles de souris.
Depuis 2015, les équipes du généticien George Church, à l'université de Harvard, ont pour objectif de produire un embryon hybride entre un éléphant et un mammouth, grâce au ciseau moléculaire Crispr Cas9 (Prix Nobel de chimie 2020) qui permet de couper l'ADN à l'endroit voulu. Ils pourraient aussi extraire et remplacer certaines parties du génome d'un éléphant d'Asie par des fragments d'ADN issus de mammouths conservés quasi intacts dans la glace de Sibérie.
https://news.harvard.edu/gazette/story/2014/10/behold-the-mammoth-maybe/
Dans le monde, beaucoup de paléogénéticiens se sont prononcés contre l'idée de faire renaitre les espèces disparues.
https://www.youtube.com/watch?v=YEeptf_OBUg Colossal Biosciences
https://www.youtube.com/watch?v=61VSrMVTGaY
Dodo ressurection !
In the late 17th century. man brought an abrupt end to the dodo species. Today, Colossal, company in biotechnology, is committed to bringing it back."There has never been more urgency to preserve species than there is today. It’s not just important for their continued existence. It’s for the greater good of the planet. Together, Colossal and the scientific community at large are committed to our efforts to de-extinct those we’ve lost." said the leader of the team that sequences and assembles the dodo's genome using DNA extracted from a skull in the collection of the Natural History Museum of Denmark. Of course chicken and pigeon's DNA and CrisprCas9 are going to be used to make the dodo live again! 02/23
À la fin du XVIIe siècle, l'homme a brutalement mis fin à l'espèce du dodo. Aujourd'hui, Colossal, entreprise de biotechnologie, s'engage à la faire revivre. "Il n'a jamais été aussi urgent de préserver les espèces qu'aujourd'hui. Ce n'est pas seulement important pour leur survie. C'est pour le plus grand bien de la planète. Ensemble, Colossal et la communauté scientifique dans son ensemble s'engagent dans nos efforts pour faire revivre ceux que nous avons perdus", a déclaré le chef de l'équipe chargée de séquencer et d'assembler le génome du dodo à partir de l'ADN extrait d'un crâne appartenant à la collection du Musée d'histoire naturelle du Danemark. Bien entendu, l'ADN de poulet et de pigeon, et CrisprCas9 seront utilisés pour faire revivre le dodo !
He Jiankui, the scientist behind the first babies genetically modified by CrisprCas9, has just been released after 3 years in prison. He had announced in 2018 that he had enabled the birth of twin girls with DNA modified to make them resistant to the HIV virus - a mutation in the CCR5 receptor that prevents the HIV virus from going into the immune cell LT4. The scientist modified the DNA of human embryos before implanting them in two women. There is a big concern about the children born. Untargeted base insertions or deletions can have serious consequences for their health. One study found 16% of unexpected genetic changes were noticed on Crispr-cas9-modified human embryos. 04/22
He Jiankui, le scientifique à l'origine des premiers bébés génétiquement modifiés par CrisprCas9, vient d'être relâché après 3 ans de prison. Le chercheur avait annoncé en 2018 avoir permis la naissance de jumelles avec un ADN modifié afin de les rendre résistantes au virus VIH soit une mutation au niveau du récepteur CCR5 qui empêche ainsi le virus VIH de pénétrer dans la cellule immunitaire. Le scientifique a modifié l'ADN des embryons humains avant de les implanter chez deux femmes. Beaucoup d'inquiétudes concernant les enfants issus de cette manipulation. En effet, des insertions ou délétions de bases, non ciblées, peuvent entraîner de graves conséquences sur leur santé. Une étude a relevé 16% de modifications génétiques non attendues sur des embryons humains modifiés par Crispr-cas9. 04/22
Genetically modified cattle may be sold for food in US. FDA gave the go-ahead for the commercialization of cattle genetically modified to better resist climate change. Using Crispr-Cas9, the company has modified the beef genome to give these cattle a shorter, smoother coat that is better adapted to heat waves. Initially, this genetic mutation occurs naturally in certain cattle living in tropical areas. Cows carrying this mutation have a body temperature 1 degree lower and give 55 cl more milk. The FDA approved this commercialization, judging that such a genome modification represents only a low risk for food consumption.
La FDA vient de donner son accord pour la commercialisation de bovins génétiquement modifiés pour mieux résister au changement climatique. Grâce à Crispr-Cas9, la companie a modifié le génome de boeuf afin que ces bovins aient un poils plus court, plus lisse et plus adapté aux vagues de chaleur. Initialement, cette mutation génétique est naturellement présente chez certains bovins habitant dans des zones tropicales. Les vaches porteuses de cette mutation ont une température corporelle inférieure de 1 degré et donnent 55 cl de lait en plus. La FDA a approuvé cette commercialisation jugeant qu'une telle modification du génome ne représentait qu'un faible risque pour la consommation alimentaire. 03/22
The first CRISPR tomatoes, first food to be on the market (in Japan). These tomatoes have been genetically modified using CRISPR-Cas-9 technology.
They contain 5 times more amino acids than a non genetically modified tomato, and 5 times more GABA. The Japanese start-up's engineers cut a
piece of DNA so that the tomato no longer expresses an enzyme that breaks down GABA, a neurotransmitter that inhibits the central nervous system. According to studies, this GABA is helpful to reduce
stress, improve mood regulation and lower blood pressure.
Numerous other CRISPR products are expected to follow: Canada's CRISPR corn and a Japanese CRISPR sea bream, modified to double the muscle mass. 09/21
Les premières tomates CRISPR, soit les premiers aliments mis sur le marché (au Japon). Ces tomates ont été modifiées génétiquement par la technologie CRISPR-Cas-9. Elles contiennent 5 fois plus d'acides aminés qu'une tomate naturelle et aussi 5 fois plus de GABA. Les ingénieurs de la start up japonaise ont coupé un morceau d'ADN afin que la tomate n'exprime plus une enzyme qui décompose le GABA, un neurotransmetteur inhibiteur du système nerveux central. Ce GABA serait associé, selon des études, à une diminution du stress, une amélioration de la régulation de l'humeur, et une moindre tension artérielle.
De nombreux autres produits CRISPR sont attendus: le mais CRISPR au Canada ainsi qu'une dorade CRISPR japonaise, modifiée pour produire deux fois plus de muscles. 09/21
https://www.science.org/doi/10.1126/science.aax2537
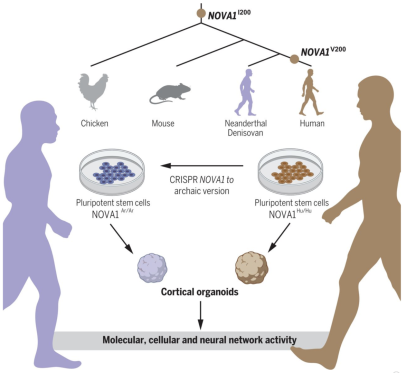
A study describes the synthesis of organoid brains with Neanderthal genes. An American team wanted to better understand the impact of genetic differences between Neanderthals and Homo Sapiens. Our genomes are broadly similar, but with 61 different genes. For example, Neanderthals have only one different base pair for the NOVA1 gene, which is important for the development of the brain and nervous system. The researchers used CRISPR-CaS9 genetic scissors on human stem cells to modify this gene and make it archaic. They then made modern and Neanderthal organoids grow up. These organoid brains are smaller and multiply more slowly than modern organoids. The modification of a single base can therefore change the whole development of the brain, and the "modern" version of NOVA1 may have been an evolutionary advantage for our species.
Une étude décrit la création de cerveaux organoides avec des gènes de Néandertal. Une équipe américaine a voulu mieux comprendre l'impact des différences génétiques chez Néandertal et Homo Sapiens. Nos génomes sont globalement similaires mais nous avons 61 gènes différents. Par exemple, les Néandertaliens n'ont qu'une seule paire de bases différente pour le gène NOVA1, un gène important pour le développement du cerveau et du système nerveux. Les chercheurs ont utilisé les ciseaux génétiques CRISPR-CaS9 sur des cellules souches humaines pour modifer ce gène et le rendre archaique. Puis, ils ont cultivé des organoides modernes et néandertaliens. Ces derniers se sont montrés plus petits et leurs cellules se multipliaient plus lentement que les organoides modernes. L'altération d'une seule base peut donc changer tout le développement du cerveau, et la version moderne de NOVA1 a peut-être été un avantage évolutif pour notre espèce. 02/21
https://www.chemistry.harvard.edu/news/base-editing-successfully-treats-progeria-mice
According to a Harvard University study, CRISPR Cas9 can double the life expectancy of mice suffering from progeria. Progeria (Hutchinson-Guilford syndrome) is a very rare genetic disorder that causes accelerated aging in children. The average life expectancy of progeria patients is 12 to 13 years. The disease is caused by an alteration in lamin A/C, two structural proteins of the nuclear envelope of cells. A single mutation in the lamin gene (T instead of C) results in the production of a toxic protein called progerin, which is harmful to the structure of the cell nucleus. The Harvard team used the CRISPR Cas9 molecular scissors not to cut one DNA sequence with another, but to replace one DNA letter with another, a process called base editing. The researchers were thus able to correct the letter responsible for almost all cases of progeria in this gene, which produces the deficient lamin A. The result is spectacular: mice suffering from progeria that underwent this CRISPR Cas9 modification saw their life expectancy double from 215 to 510 days. 01/21
Selon une étude de l'Université de Harvard, CRISPR Cas9 doublerait l'espérance de vie de souris atteintes de progeria. La progeria (syndrome de Hutchinson- Guilford) est une maladie génétique très rare qui provoque un viellissement accéléré des enfants qui en souffrent. L'espérance de vie des patients atteints de progeria est de 12 à 13 ans en moyenne. Cette pathologie est causée par une altération des lamines A/C, deux protéines structurales de l'enveloppe nucléaire des cellules. Une seule mutation au niveau du gène de la lamine (T à la place d'un C) entraine la production d'une protéine toxique appelée progérine qui est nocive pour la structure du noyau et docn de la cellule. L'équipe de Harvard a utilisé le ciseau moléculaire CRISPR Cas9 non pas pour couper une séquence d'ADN par une autre, mais pour remplacer une lettre de l'ADN par une autre, processus appelé édition de base. Les chercheurs ont ainsi pu corriger la lettre responsable de presque tous les cas de progeria dans ce gène qui produit la lamine A déficiente. Le résultat est spectaculaire puisque les souris atteintes de progeria qui ont été l'objet de cette modification par CRISPR Cas9 ont vu leur espérance de vie multipliée par deux passant de 215 à 510 jours. 01/21